-
清华医学院布莱恩·克比尔卡研究组揭示beta2肾上腺素受体胞内别构拮抗剂的工作机理
清华新闻网8月18日电 8月17日,清华大学医学院、结构生物学高精尖创新中心教授、千人计划入选者布莱恩·克比尔卡 (Brian Kobilka)研究组在《自然》(Nature)期刊在线发表题为《利用X射线晶体结构揭示beta2肾上腺素受体胞内别构拮抗剂的工作机理》的文章 (Mechanism of intracellular allosteric β2AR antagonist reveled by X-ray crystal structure),首次报道了beta2肾上腺素受体同时结合正构拮抗剂卡拉洛尔(carazolol)与胞内别构拮抗剂Cmpd-15的复合物结构,该成果对G蛋白偶联受体别构调节物的研发具有指导意义。
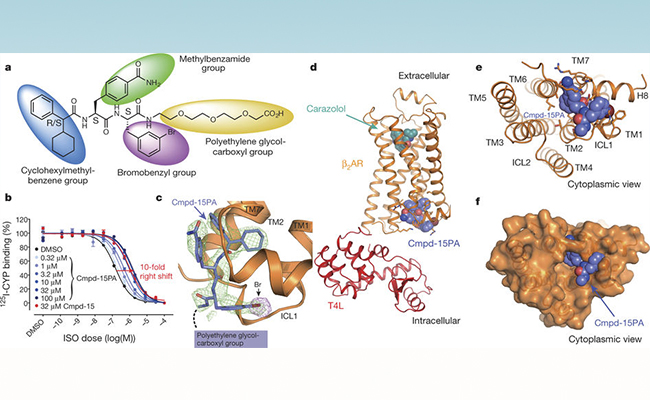
beta2肾上腺素受体和Cmpd-15PA(即修饰后的cmpd-15)复合物的整体结构。其中a是Cmpd-15PA的化学结构,b是Cmpd-15PA活性数据,c是Cmpd-15PA的电子密度(晶体学数据),d-f展示了复合物的整体结构,清楚表明Cmpd-15结合在beta2肾上腺素受体的胞内部分。
G蛋白偶联受体是一类具有七次跨膜结构的膜蛋白受体。这类受体可以感知包括气味分子、激素、神经递质、趋化因子等信号,从而调节生理反应。G蛋白偶联受体是一类重要的药物靶标,大约30%的商业化药物以G蛋白偶联受体作为靶点。由于对G蛋白偶联受体结构和功能研究的杰出贡献,布莱恩·克比尔卡教授和罗伯特·莱夫科维茨教授分享了2012年的诺贝尔化学奖。
传统上针对G蛋白偶联受体的药物研发工作主要以其正构底物结合位点(即天然底物结合位点)为靶点。这类正构底物结合位点在不同亚型的G蛋白偶联受体之间往往非常保守。例如,在人体中一共有九个肾上腺素受体,它们都可以被肾上腺素激活,所以其正构底物结合位点十分相似。这就导致研发出的药物往往对不同亚型的特异性不够,造成药物副作用。别构调节物指的是不结合在G蛋白偶联受体正构底物结合位点的小分子化合物。其结合位置通常保守性较低,因此有可能具有更好的特异性。目前报道的G蛋白偶联受体结构大多数都是结合了正构拮抗剂,只有极少数结构里面结合了别构调节物。布莱恩·克比尔卡教授自从在清华大学建立实验室以来,一直保持和世界上不同实验室合作,共同研发G蛋白偶联受体的别构调节物,并利用结构生物学的方法研究别构调节物发挥功能的分子机理。
胞内别构拮抗剂第15号化合物(Cmpd-15)是罗伯特·莱夫科维茨研究组利用亲和筛选的方式,从DNA编码的小分子化合物库里面鉴定出来的一个beta2肾上腺素受体别构拮抗剂 (Ahn, S. et al. 2017)。生化实验表明,第15号化合物可能穿过细胞膜,结合在beta2肾上腺素受体的胞内位置。Beta肾上腺素受体的正构拮抗剂,即乙型阻滞剂(beta-blocker)是一类极为重要的处方药。而Cmpd-15是第一个别构型的乙型阻滞剂,其重要性不言而喻。
在这项工作中,布莱恩·克比尔卡研究组利用一个beta2肾上腺素受体和T4溶菌酶的融合蛋白(β2AR-T4L)进行晶体学研究。研究初期利用T4溶菌酶的融合蛋白与Cmpd-15共结晶,获得了2.5埃的晶体数据。但是由于胞内别构拮抗剂Cmpd-15溶解性很差,在结晶条件中最高只能加到200uM。在晶体数据里虽然看到胞内部分有很弱的电子密度,但是无法准确判断其结合方式。后来合作研究组对Cmpd-15进行了修饰,在其上加入一个羧酸聚乙二醇基团以提高其溶解度。改造后的小分子即为Cmpd-15PA。 布莱恩·克比尔卡研究组又获得了T4溶菌酶的融合蛋白与Cmpd-15PA复合物2.7埃的晶体结构。其晶体数据清楚地揭示了Cmpd-15的结合方式,羧酸聚乙二醇基团在晶体中处于柔性不可见的状态。Cmpd-15结合在跨膜螺旋1、2、6、7的胞内端与胞内环1以及螺旋8形成的底物口袋。结构分析、分子动态模拟以及生化实验结果表明,Cmpd-15通过两种方式形成功能:一是通过稳定跨膜螺旋6,将beta2肾上腺素受体稳定在非激活状态,从而影响正构底物的亲和力;二是直接与下游信号蛋白如G蛋白或者抑制蛋白 (arrestin)竞争,干扰下游信号传导。
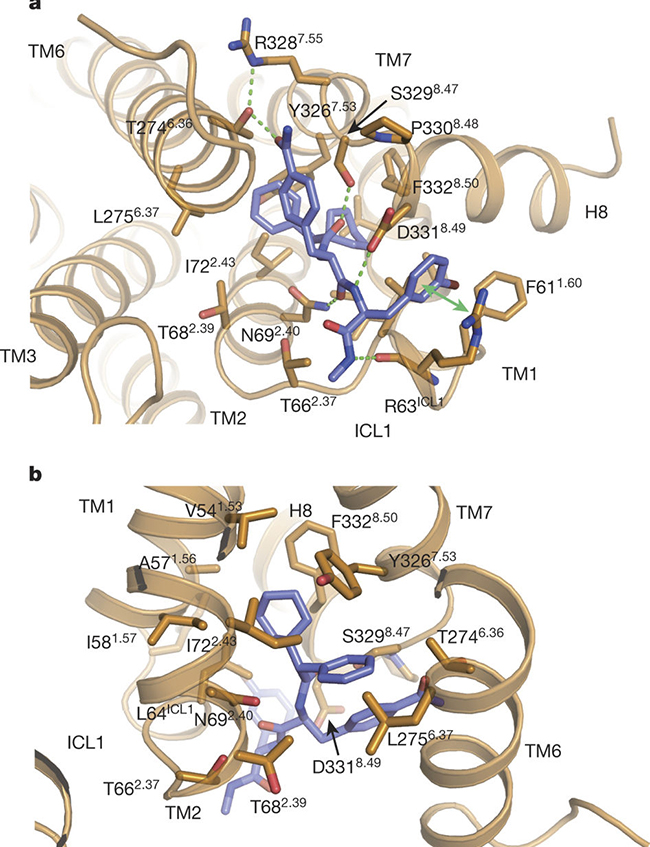
beta2肾上腺素受体和Cmpd-15PA结合的细节。
清华医学院布莱恩·克比尔卡研究组揭示beta2肾上
发布日期:2019-05-28 来源:网络整理 浏览量:
次
- 相关新闻:
最新新闻
热门新闻